Importation d'ampoules de Cisatracurio Hikma à 2 mg/mL autorisées en Italie en raison de la pénurie actuelle de Cisatracurium Omega autorisé au Canada
Résumé
Voir les messages clés ci-dessous
Produits visés
Nom de la marque du produit |
Forme posologique, concentration, format d'emballage et voie d'administration |
Pays d’autorisation et code d’identification |
Fabricant |
Importateur au Canada |
|---|---|---|---|---|
Cisatracurio Hikma 2 mg/mL |
Solution injectable/pour perfusion, 2 mg/mL (20 mg/10 ml), Ampoule en verre transparent à usage unique de 10 mL avec une pointe coupée marquée d'un point blanc, Voie intraveineuse uniquement |
Italie AIC 044195093 |
Hikma Farmacêutica (Portugal), S.A. |
Hikma Canada Limited |
Problème
Compte tenu de la nécessité médicale du Cisatracurium Omega (Bésylate de cisatracurium injectable 2 mg/mL) et pour maintenir la continuité de l'approvisionnement au Canada, Santé Canada a autorisé l'importation et la vente exceptionnelle et temporaire du Cisatracurio Hikma 2 mg/mL autorisé en Italie avec des étiquettes en italien seulement par Hikma Canada Limited pour atténuer la pénurie.
Destinataires
Professionnels de la santé, notamment les pharmaciens, les anesthésistes, les médecins de soins intensifs, les urgentistes et les personnes impliquées dans l'anesthésie ou l'intubation des patients.
Messages clés
- En raison d'une pénurie de Cisatracurium Omega (Bésylate de cisatracurium injectable, 2 mg/mL) au Canada et compte tenu de la nécessité médicale de cet agent bloquant neuromusculaire non dépolarisant, Santé Canada a autorisé l'importation et la vente exceptionnelle et temporaire de produit autorisé en Italie de Cisatracurio Hikma 2 mg/mL avec des étiquettes en italien seulement.
- Cisatracurio Hikma 2 mg/mL, autorisé en Italie, est emballé dans des ampoules en verre transparent à usage unique de 10 mL et donc N'A PAS de virole (joint métallique sur le flacon) ni de capuchon pour afficher le texte distinctif : « AVERTISSEMENT : AGENT PARALYSANT » ou « AGENT PARALYSANT » (voir Annexe 1).
- Il est conseillé aux professionnels de santé de :
- Soyez conscient des différences importantes entre les produits Cisatracurio Hikma 2 mg/mL autorisés en Italie et les produits Cisatracurium Omega autorisés au Canada (voir la section Information à l’intention des professionnels de la santé).
- Soyez conscient du risque potentiel d'erreurs résultant de la sélection et de l'administration par inadvertance d'agents de blocage neuromusculaire non dépolarisants, entraînant des dommages graves aux patients.
- Consultez la monographie de produit canadienne Cisatracurium Omega à dose unique (Bésylate de cisatracurium injectable, 2 mg/mL) par Omega Laboratories Limited, disponible en anglais et en français dans la base de données sur les produits pharmaceutiques de Santé Canada pour obtenir des informations sur une utilisation appropriée.
- Sachez que les produits Cisatracurio Hikma 2 mg/mL autorisés en Italie et les produits Cisatracurium Omega autorisés au Canada ne doivent PAS être dilués dans l'injection de Ringer lactate en raison de l'instabilité chimique.
- La sélection appropriée du produit prévu doit être confirmée pour éviter toute confusion avec d'autres médicaments injectables disponibles en ampoules.
Contexte
Cisatracurium Omega (Bésylate de cisatracurium injectable, 2 mg/mL) est un agent bloquant neuromusculaire non dépolarisant avec un début et une durée d'action intermédiaires indiqué comme complément à l'anesthésie générale, pour faciliter l'intubation endotrachéale non urgente et pour assurer la relaxation des muscles squelettiques pendant chirurgie ou ventilation mécanique.
En raison d'une pénurie de Cisatracurium Omega (Bésylate de cisatracurium injectable, 2 mg/mL) au Canada, Santé Canada a autorisé l'importation et la vente exceptionnelle et temporaire du Cisatracurio Hikma 2 mg/mL autorisé en Italie afin de maintenir la continuité de l'approvisionnement.
Information à l’intention des professionnels de la santé
Ce médicament doit être administré par des professionnels de la santé dûment formés et familiers avec ses actions, ses caractéristiques et ses dangers.
Au Canada, les agents bloquants neuromusculaires sont généralement fournis dans des flacons portant un texte distinctif sur la virole (joint métallique sur le flacon) et le capuchon : « AVERTISSEMENT : AGENT PARALYSANT » ou « AGENT PARALYSANT ». Les professionnels de la santé canadiens qui administrent des agents bloquants neuromusculaires sont habitués à cette pratique d'étiquetage et d'emballage, qui a été adoptée par l'industrie comme stratégie pour identifier facilement les agents bloquants neuromusculaires afin qu'ils ne soient pas confondus avec d'autres produits.
Santé Canada est au courant de rapports nationaux et internationaux faisant état de confusions entre agents bloquants neuromusculaires causant des dommages graves, y compris la mort; certaines de ces erreurs sont liées à des changements dans l’étiquetage et l’emballage de ces produits.
Les professionnels de la santé doivent être conscients qu'il existe des différences importantes entre les produits Cisatracurio Hikma 2 mg/mL autorisés en Italie et les produits Cisatracurium Omega autorisés au Canada (voir Tableau 1).
Tableau 1 : Différences entre Cisatracurio Hikma 2 mg/mL autorisés en Italie et Cisatracurium Omega dose unique et Cisatracurium Omega multidose autorisés au Canada
|
|
Produit pharmaceutique destiné à l'importation |
Produit pharmaceutique canadien |
|
|
Nom de marque du produit, forme posologique et concentration |
Cisatracurio Hikma 2 mg/mL
Solution injectable/pour perfusion
2 mg/mL de cisatracurium (sous forme de bésylate de cisatracurium) |
Cisatracurium Oméga Dose Unique
Solution injectable/pour perfusion
2 mg/mL de Cisatracurium (sous forme de bésylate de cisatracurium)* |
Cisatracurium Oméga Multidose
Solution injectable/pour perfusion
2 mg/mL de cisatracurium (sous forme de bésylate de cisatracurium) |
|
Code d'identification |
AIC 044195093 |
DIN 02408805 |
DIN 02408813 |
|
Emballage |
Ampoule, avec une pointe coupée marquée d'un point blanc (dose unique) |
Flacon |
Flacon |
|
Volume
|
10 mL |
5 mL |
10 mL |
|
Contient l'avertissement : « AVERTISSEMENT : AGENT PARALYSANT » ou « AGENT PARALYSANT » |
Pas d'avertissement |
Contient un avertissement |
Contient un avertissement |
|
Contient une virole (joint métallique sur le flacon) |
Non |
Oui |
Oui |
|
Conservateur |
Sans conservateur |
Sans conservateur |
alcool benzylique 0,9% |
*Ce produit n’est actuellement pas commercialisé et est répertorié comme « dormant » dans la base de données sur les produits pharmaceutiques de Santé Canada.
La sélection appropriée des produits prévus doit être confirmée pour éviter toute confusion avec d'autres médicaments injectables disponibles en ampoules.
Il est conseillé aux professionnels de la santé de :
- Le produit autorisé en Italie peut être utilisé de la même manière que le Cisatracurium Omega Single Dose (Bésylate de cisatracurium injectable, 2 mg/mL) autorisé au Canada. Consultez la monographie de produit canadienne Cisatracurium Omega à dose unique (Bésylate de cisatracurium injectable, 2 mg/mL) par Omega Laboratories Limited, disponible en anglais et en français dans la base de données sur les produits pharmaceutiques de Santé Canada pour obtenir des informations sur une utilisation appropriée.
- La traduction anglaise et française de Hikma du résumé des caractéristiques du produit de Cisatracurio Hikma 2 mg/mL est disponible à l'adresse https://products.hikma.com/Images/SmPC-Cisatracurio.pdf pour référence.
- Il faut faire preuve de prudence en cassant l'ampoule en verre et en aspirant la solution conformément aux normes de soins établies par l'établissement.
- Les produits Cisatracurio Hikma 2 mg/mL autorisés en Italie et les produits Cisatracurium Omega autorisés au Canada ne doivent PAS être dilués dans l'injection de Ringer lactate en raison de l'instabilité chimique.
- Des mesures supplémentaires soulignant que le produit autorisé en Italie est un agent bloquant neuromusculaire, telles que des étiquettes auxiliaires, devraient être envisagées par les hôpitaux.
Mesures prises par Santé Canada
Pour aider à atténuer la pénurie de Cisatracurium Omega (Bésylate de cisatracurium injectable, 2 mg/mL) au Canada, Santé Canada a autorisé l'importation et la vente exceptionnelle et temporaire du Cisatracurio Hikma 2 mg/mL autorisé en Italie par Hikma Canada Limited et a ajouté ce produit à la Liste des drogues destinées aux importations et aux ventes exceptionnelles.
Santé Canada a travaillé avec Hikma Canada Limited pour préparer cette alerte concernant le cisatracurium injectable. Santé Canada communique ces renseignements importants en matière de sécurité aux professionnels de la santé et aux Canadiens via la base de données sur les rappels et les alertes de sécurité sur le site web Canadiens en santé. Cette mise à jour de communication sera ensuite distribuée via le système de notification par courrier électronique MedEffet™ e-Notice.
Pour signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés à un produit de santé commercialisé dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout cas grave ou tout autre effet indésirable grave ou imprévu chez les patients recevant Cisatracurio Hikma 2 mg/mL devrait être signalé à Hikma Canada Limited ou à Santé Canada.
Hikma Canada Limited
5995 Avebury Road, Suite 804
Mississauga, Ontario, L5R 3P9
Téléphone: 1-800-656-0793
Fax: 416-485-8352
Pour corriger votre adresse postale ou numéro de télécopieur, veuillez communiquer avec Hikma Canada Limited.
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirable en ligne, par courrier ou par télécopieur.
Pour d’autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada :
Direction générale des opérations réglementaires et de l’application de la loi
Courriel : hpce-cpsal@hc-sc.gc.ca
Téléphone : 1-800-267-9675
Originale signée par
Mike Armstrong
Directeur de pays pour le Canada
Hikma Canada Limited
Annexe 1 :
A. Photos de Cisatracurio Hikma 2 mg/mL avec étiquetage en italien uniquement
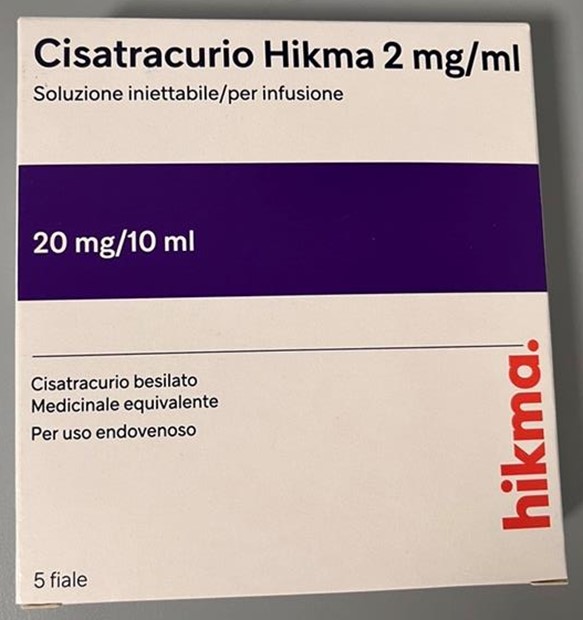

B. Étiquette de l'ampoule de Cisatracurio Hikma 2 mg/mL

C. Étiquette de l'ampoule Cisatracurio Hikma 2 mg/mL traduite en français

D. Étiquette de la boîte de Cisatracurio Hikma 2 mg/mL
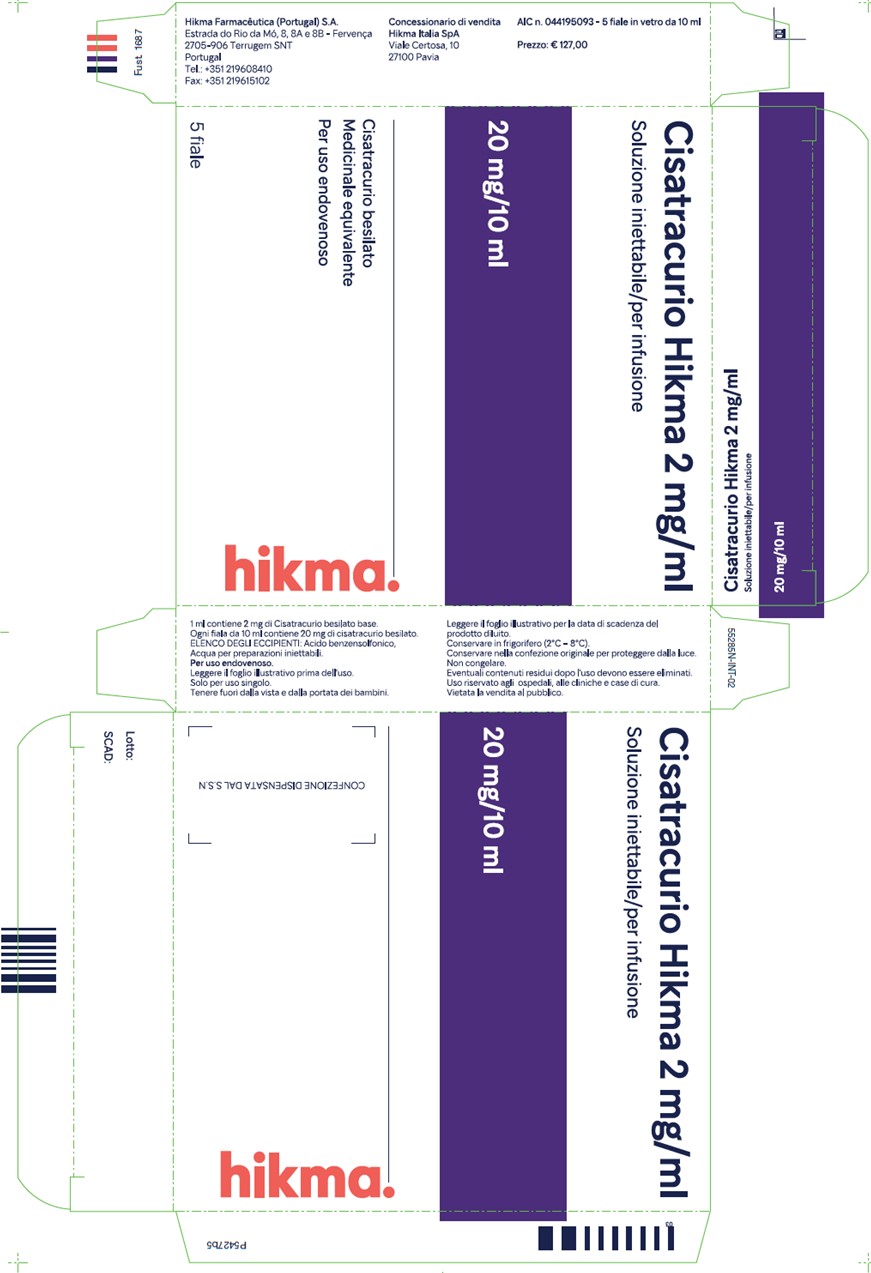
E. Étiquette du carton de Cisatracurio Hikma 2 mg/mL traduite en français

Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des notifications pour les rappels et les avis de sécurité nouveaux et mis à jour, par catégorie.