Importation du Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, en raison de la pénurie actuelle de Bicillin L-A 1 200 000 UI / 2 mL autorisé au Canada
Marque(s)
Résumé
Voir les messages clés ci-dessous
Produits visés
| Nom de marque | Forme pharmaceutiq ue et voie d'administration | Pays d'autorisation et code d'identification | Fabriqué par | Importateur au Canada |
|---|---|---|---|---|
| Lentocilin S1200 1 200 000 IU / 4 mL | Poudre et solvant pour suspension injectable. Intramusculaire | Portugal 9908301 | Laboratórios Atral, S.A. | Septa Pharmaceuticals Inc. |
Problème
Compte tenu de la nécessité médicale de Bicillin L-A 1 200 000 UI / 2 mL et de la nécessité de maintenir la continuité de l'approvisionnement au Canada, Santé Canada a autorisé l'importation et la vente exceptionnelles et temporaires du Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, fabriqué par Laboratórios Atral, S.A., avec un étiquetage en anglais seulement, par Septa Pharmaceuticals Inc., afin d'atténuer la pénurie.
Lentocilin S a le même ingrédient actif, le même dosage (1 200 000 UI) et la même voie d'administration (intramusculaire) que Bicillin L-A. Cependant, il existe des différences dans la formulation, la forme posologique, les exigences de reconstitution et la présentation entre Lentocilin S et Bicillin L-A. Il est conseillé aux professionnels de la santé d'améliorer la surveillance de la sécurité du médicament importé, y compris la surveillance des effets indésirables potentiels.
Destinataires
Les professionnels de la santé, y compris les médecins, les infirmiers et infirmières, les pharmaciens d'hôpitaux, les cliniques de santé publique et de santé sexuelle, les groupements d'achat et les grossistes.
Messages clés
- En raison d'une pénurie critique de l'antibiotique Bicillin L-A 1 200 000 UI / 2 mL au Canada et compte tenu de la nécessité médicale de ce médicament, Santé Canada a autorisé l'importation et la vente exceptionnelles et temporaires du Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, avec un étiquetage en anglais seulement.
- Lentocilin S a le même ingrédient actif, le même dosage (1 200 000 UI) et la même voie d'administration (intramusculaire) que Bicillin L-A. Cependant, Lentocilin S a une formulation, une forme posologique, des exigences de reconstitution et une présentation différentes de celles de Bicillin L-A (voir Annexe 1).
- Il est conseillé aux professionnels de la santé de:
- Être conscients que l'ingrédient actif (benzathine benzylpénicilline) de Lentocilin S est identique à l'ingrédient actif (pénicilline G benzathine) de Bicillin L-A. Les produits utilisent une nomenclature différente sur leurs étiquettes.
- Être conscients que Lentocilin S est fourni sous forme de poudre en flacon, à reconstituer avec le diluant co-emballé contenant du chlorhydrate de lidocaïne à 1,5% (volume final 4 mL), tandis que Bicillin L-A est fourni sous forme de suspension dans une seringue préremplie prête à l'emploi et ne contient pas de lidocaïne (volume final 2 mL) (voir rubrique Informations à l’intention des professionnels de santé).
- Être conscients que Lentocilin S contient des phospholipides de soja et peut provoquer des réactions d'hypersensibilité (urticaire, choc anaphylactique) chez les patients ayant des antécédents d'allergie au soja.
- Consultez les indications et l'encadré Mises en garde et précautions importantes, y compris les informations relatives aux réactions indésirables cutanées sévères (SCAR) associées à la pénicilline G benzathine, dans la monographie canadienne de produit de Bicillin L-A de Pfizer Canada ULC, disponible en anglais et en français sur la Base de données sur les produits pharmaceutiques de Santé Canada.
- Reportez-vous au Résumé des caractéristiques du produit (RCP) de Lentocilin S en anglais et en français pour obtenir des informations spécifiques au produit sur le dosage, la préparation et l'administration, les mises en garde et les précautions, ainsi que l’entreposage et la manipulation.
Contexte
Bicillin L-A (pénicilline G benzathine intramusculaire) est indiqué dans le traitement des infections causées par des micro-organismes sensibles à la pénicilline G qui sont sensibles aux taux sériques faibles et très prolongés propres à cette forme posologique particulière.
Le traitement doit être guidé par des études bactériologiques (y compris des tests de sensibilité) et par la réponse clinique.
Actuellement, il existe une pénurie critique de Bicillin L-A 1 200 000 UI / 2 mL autorisé au Canada. Afin d'atténuer cette pénurie, Santé Canada a autorisé l'importation et la vente exceptionnelles et temporaires du Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, avec un étiquetage en anglais seulement.
Information à l’intention des professionnels de la santé
Lentocilin S a le même ingrédient actif, le même dosage (1 200 000 UI) et la même voie d'administration (intramusculaire) que Bicillin L-A. Cependant, il existe des différences dans la formulation, la forme posologique, les exigences de reconstitution et la présentation, entre autres caractéristiques, qu'il est important de noter (voir tableau 1).
Tableau 1 : Principales différences entre Lentocilin S 1200 ; 1 200 000 UI / 4 mL et Bicillin L-A 1 200 000 UI / 2 mL
|
|
Produit pharmaceutique portugais destiné à l'importation |
Produit pharmaceutique canadien |
|
Nom de marque du produit, forme pharmaceutique et dosage |
Lentocilin S 1200 (Laboratórios Atral, S.A., Portugal)
Chaque flacon contient 1 200 000 UI de benzathine benzylpénicilline 1 200 000 UI / 4 mL, poudre et solvant pour suspension |
Bicillin L-A (Pfizer Canada ULC)
pénicilline G benzathine 1 200 000 UI par 2 mL de suspension injectable |
|
Code d'identification |
9908301 |
DIN 02291924 |
|
Présentation du produit |
Chaque unité se compose d'un flacon en verre transparent pour injection (poudre) et d'une ampoule en verre ambré contenant le diluant. |
Seringue préremplie de 2 mL prête à l'emploi |
|
Reconstitution |
Reconstituer immédiatement avant l'utilisation.
Se référer au RCP de Lentocilin S pour les instructions. |
Aucune |
|
Administration |
Chez les nourrissons de moins de 2 ans, et si cela est jugé nécessaire, la dose peut être divisée et administrée en deux sites d'injection distincts.
Une aiguille d'un calibre minimum de 18 est requise pour administrer Lentocilin S. |
Aucune mention de dose fractionnée chez les nourrissons. |
|
Ingrédients médicinaux et non médicinaux supplémentaires nécessitant une attention particulière |
Le chlorhydrate de lidocaïne (présent dans l'ampoule contenant le diluant) est identifié comme un ingrédient non médicinal dans le RCP de Lentocilin S, il doit être utilisé avec prudence dans des populations spécifiques, notamment en présence de dysfonctionnement cardiovasculaire, hépatique ou rénal, d'inflammation et/ou d'infection au site d'injection ou de sensibilité aux anesthésiques locaux de type amide; chez les enfants, les personnes âgées et les patients atteints de maladies aiguës ou affaiblis; et chez les patients prenant simultanément des médicaments dépresseurs du système nerveux central (SNC).
Phospholipides de soja - peuvent provoquer des réactions d'hypersensibilité (urticaire, choc anaphylactique) chez les patients ayant des antécédents d'allergie au soja. |
Aucun |
|
Conservation |
Conserver à une température inférieure à 25 °C. Conserver dans l'emballage d'origine afin de protéger le produit de la lumière et de l'humidité. |
Conserver au réfrigérateur (2°-8 °C). Peut être retiré du réfrigérateur et conservé pendant 7 jours à une température ne dépassant pas 30 °C. Protéger du gel. |
Les professionnels de la santé sont informés que:
- En raison de la formulation différente du produit, une surveillance accrue de la sécurité du médicament importé pour l'état pathologique visé est recommandée, y compris la surveillance des effets indésirables potentiels.
- Lentocilin S contient des phospholipides de soja et peut provoquer des réactions d'hypersensibilité (urticaire, choc anaphylactique) chez les patients ayant des antécédents d'allergie au soja. Le diluant co-emballé contient du chlorhydrate de lidocaïne et doit être utilisé avec prudence dans des populations spécifiques, y compris celles sensibles aux anesthésiques locaux de type amide.
- Le produit Lentocilin S reconstitué doit être administré immédiatement après la reconstitution. Notez qu'il existe une différence dans le volume d'injection de Lentocilin S reconstitué (4 mL) par rapport à Bicillin L-A (2 mL).
- Une aiguille d'un calibre minimum de 18 est requise pour administrer Lentocilin S.
- Consultez les indications et l'encadré Mises en garde et précautions importantes, y compris les renseignements relatifs aux réactions indésirables cutanées sévères (SCAR), dans la monographie canadienne de produit de Bicillin L-A de Pfizer Canada ULC, disponible en anglais et en français dans la base de données sur les produits pharmaceutiques de Santé Canada.
- Reportez-vous au Résumé des caractéristiques du produit (RCP) de Lentocilin S en anglais et en français pour obtenir des informations spécifiques au produit sur le dosage, la préparation et l'administration, les mises en garde et les précautions, ainsi que l’entreposage et la manipulation.
- Certains aspects des étiquettes de Lentocilin S peuvent différer de ceux de Bicillin L-A (voir les images de Lentocilin S en Annexe 1). La bonne sélection du produit prévu doit être vérifiée pour éviter toute confusion avec d'autres produits et pour éviter les erreurs de médication.
- Lentocilin S n'a pas de numéro d'identification de médicament (DIN) ni de code à barres pouvant être lu dans les systèmes de gestion des médicaments au Canada. Un autocollant généré par l'établissement peut être nécessaire pour permettre la lecture des codes-barres et permettre au produit distribué et administré d'être correctement identifié.
Mesures prises par Santé Canada
Santé Canada a travaillé avec Septa Pharmaceuticals Inc. pour préparer cet avis concernant le Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal. Santé Canada communique ces renseignements importants en matière d’innocuité aux professionnels de la santé et à la population canadienne par l'intermédiaire de la Base de données des rappels et des avis de sécurité sur le site Web Canadiens en santé. Cette communication sera également diffusée par le système de notification par courriel Avis électronique MedEffet de Santé Canada.
Pour signaler un problème lié à la santé ou à l’innocuité
La gestion des effets secondaires liés aux produits de santé commercialisés dépend de leur déclaration par les professionnels de la santé et les consommateurs. Tout cas d'effets secondaires graves ou inattendus chez les patients recevant Lentocilin S doit être signalé à Septa Pharmaceuticals Inc. ou à Santé Canada.
Septa Pharmaceuticals Inc.
7035 Maxwell Road, Unit 2
Mississauga, ON
L5S 1R5
Canada
Téléphone : +1 905-564-5665
Télécopieur : +1 905-564-1291
Pour corriger votre adresse postale ou votre numéro de télécopieur, veuillez communiquer avec Septa Pharmaceuticals Inc.
Vous pouvez signaler les effets secondaires soupçonnés associés à l’utilisation de produits de santé à Santé Canada :
- Composez sans frais le 1-866-234-2345; ou
- Consultez la page Web MedEffet Canada sur la déclaration des effets indésirables pour savoir comment déclarer un effet indésirables en ligne, par courrier ou par télécopieur.
Pour d’autres renseignements concernant les produits de santé reliés à cette communication, veuillez communiquer avec Santé Canada :
Direction des opérations réglementaires et de l'application de la loi
Courriel: hpce-cpsal@hc-sc.gc.ca
Téléphone: 1-800-267-9675
Devinder Kumar
Président-directeur général
Septa Pharmaceuticals Inc.
Annexe 1
Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, étiquettes de la boîte, du flacon et de l'ampoule :
Lentocilin S 1200 ; 1 200 000 UI / 4 mL autorisé au Portugal, étiquettes de la boîte
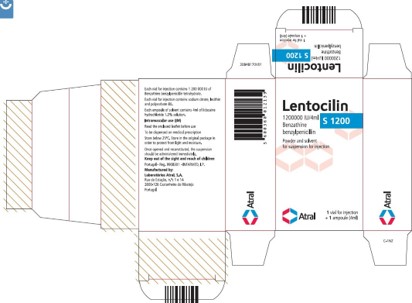
Chaque flacon pour injection contient 1 200 000 UI de benzathine benzylpénicilline tétrahydratée.
Chaque flacon pour injection contient du citrate de sodium, de la lécithine et du polysorbate 80.
Chaque ampoule de solvant contient 4 mL de solution de chlorhydrate de lidocaïne à 1,5 %.
Voie intramusculaire (IM)
Lire la notice ci-jointe avant utilisation
À être distribué sur prescription médicale
Conserver à une température inférieure à 25 °C. Conserver dans l'emballage d'origine afin de protéger le produit de la lumière et de l'humidité.
Une fois ouvert et reconstitué, la suspension doit être administrée immédiatement.
Tenir hors de la vue et de la portée des enfants
Portugal – Reg. 9908301 – INFARMED, I.P.
Fabriqué par :
Laboratórios Astral, S.A. Ruada Estação, n.°s 1 e 1A
2600-726 Castanheira do Ribatejo
Portugal
30848170V01
Atral
Lentocilin
1 200 000 UI/4mL
Benzathine
benzylpenicilline 
1 flacon pour injection
+ 1 ampoule ( 4 mL)
Lentocilin
1 200 000 UI/4mL
Benzathine
benzylpenicilline 
Poudre et solvant pour suspension injectable
Atral
1 flacon pour injection
+ 1 ampoule ( 4 mL)
Atral
Image du flacon et de l'ampoule de Lentocilin S 1200 ; 1 200 000 UI / 4 mL,
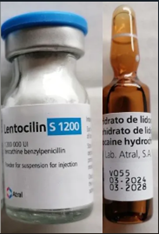
Lentocilin S 1200 ; 1 200 000 UI / 4 mL, étiquette du flacon:

Lentocilin
1 200 000 UI 
benzathine benzylpénicilline
Poudre pour suspension injectable
Atral
Voie intramusculaire (IM)
Chaque flacon contient 1 200 000 UI de benzathine benzylpénicilline.
Conserver à une température inférieure à 25 °C. Conserver dans l'emballage d'origine afin de protéger le produit de la lumière et de l'humidité.
Une fois ouvert et reconstitué, la suspension doit être administrée immédiatement.
Lentocilin S 1200 ; 1 200 000 UI / 4 mL, étiquette de l'ampoule :

Cloridrato de lidocaina 1,5 %
Clorhidrato de lidocaine 1,5 %
Chlorhydrate de lidocaïne 1,5 %
IM
Lab. Atral, S.A. PORTUGAL 4ml
Renseignements supplémentaires
Détails
Recevez des notifications
Recevez des courriels concernant les nouveaux rappels et avis de sécurité, ainsi que leurs mises à jour.